ここから本文です。
疾病等報告
| Q1 | 疾病等の定義を教えてください。 |
| A1 |
疾病とは、「特定臨床研究に起因すると疑われる疾病、傷害もしくは死亡または感染症に加え、臨床検査値の異常や諸症状を含む」とされています。 |
| Q2 | 疾病等のうち、重篤な疾病に該当するのはどのような状態でしょうか。 |
| A2 |
以下の状態の場合に、重篤と判断されます。
|
| Q3 | 疾病等が発生しました。どのような手続きが必要ですか。 |
| A3 |
速やかに被験者保護の対応をし、委員会事務局へTEL等で報告してください。委員会事務局にて、次の内容等を確認します。
病院長及び医療安全部門へ報告してください。 「重篤な疾病等」が発生した場合は、委員会への報告が必要です。(報告期限等は別表参照) 審査結果通知書(承認)発行後、引き続き委員会事務局が病院長の実施承認の手続きを行います。多施設共同研究の場合は、各実施医療機関の管理者の許可の取得を依頼してください。 |
疾病等が発生した場合
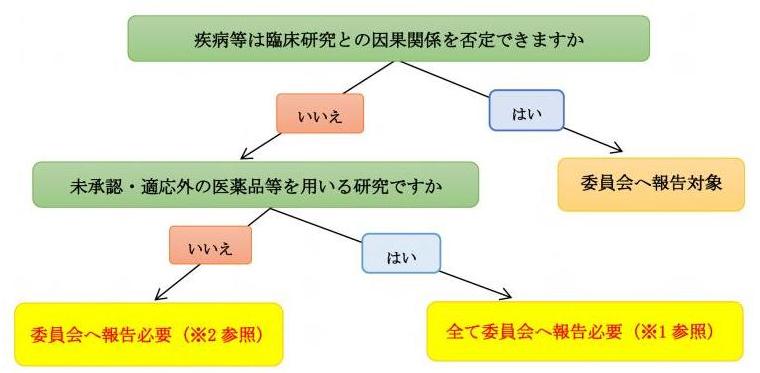
| Q4 | 疾病等が発生した場合、委員会への報告は必要ですか。 |
| A4 |
重篤な疾病等が発生した場合は、委員会での審議が必要です。 |
●委員会への報告期限
<未承認または適応外の医薬品等を用いる研究>1
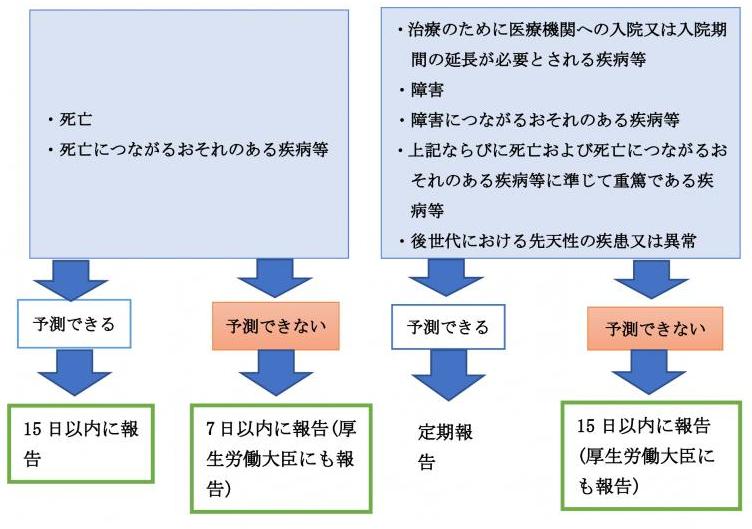
<承認内の医薬品等を用いる研究>2
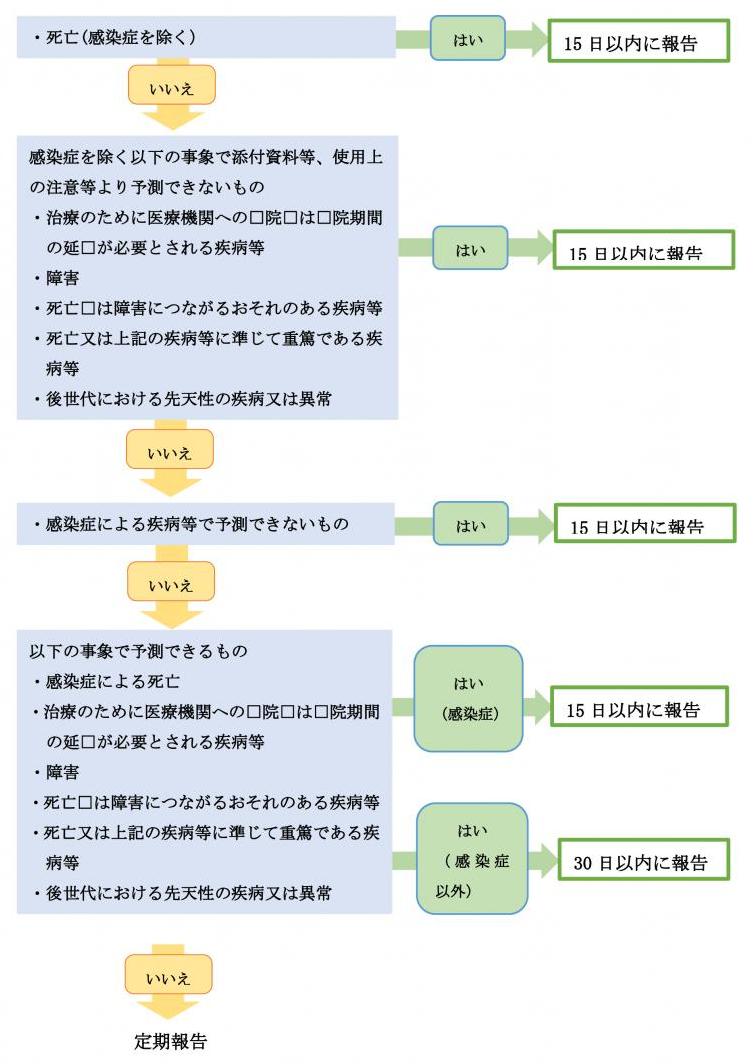
不具合の発生により疾病等が生じた場合
<医療機器・再生医療等製品を用いる研究>
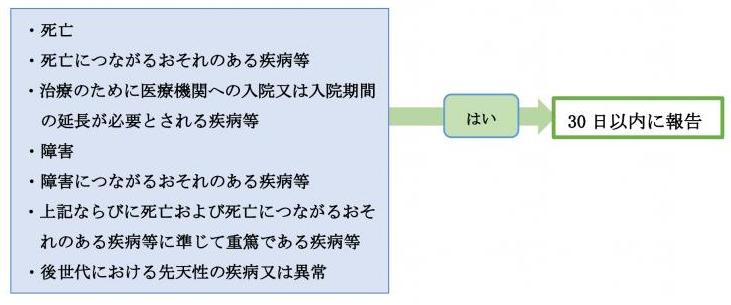
不具合とは
研究に用いる医療機器について、破損、作動不良等広く品質、安全性、性能等に関する医療機器の具合がよくないことをいい、設計、交付、保管、使用のいずれの段階によるものであるかを問わない。
| Q5 | 疾病等が発生した場合、厚生労働省への報告は必要ですか。 |
| A5 |
未承認・適応外の医薬品等によって発生した疾病等のうち、未知で重篤なものが対象になります。 |
Copyright © 奈良県立医科大学臨床研究審査会. All Rights Reserved.
